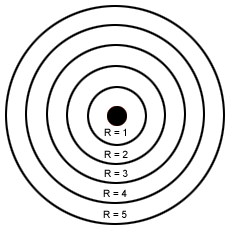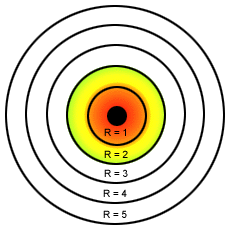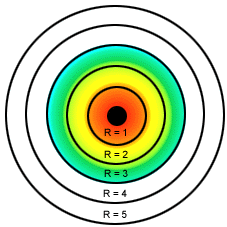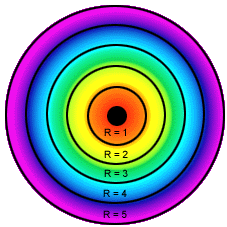
Órbitas de Bohr para o átomo de hidrogênio:
Entretanto, as órbitas extremamente distantes, tais como a décima, a vigésima ou a centésima órbita, são improváveis. É bastante provável que um elétron em uma órbita distante fosse perdido pelo átomo. Em outras palavras outro átomo o arrebataria, ou uma onda de energia eletromagnética o deixaria a esmo como um "elétron livre" movendo-se através do espaço entre os átomos. Por conseguinte, as órbitas mais importantes, aquelas que desempenham um papel principal na produção do espectro linear de um átomo, são as órbitas mais internas.
É uma lei bastante estranha esta de os elétrons poderem ocupar apenas determinadas órbitas fixas. Isto significa dizer que a maioria das órbitas seriam impossíveis. Um elétron de hidrogênio não poderia girar numa órbita a 0,250, 1,000 ou 2,150 Ângstron; as únicas órbitas permitidas são as enumeradas na figura.
Este é um comportamento muito diferente daquele dos objetos que nos cercam. Suponha que uma bola arremessada de uma sala só pudesse seguir 2 ou 3 trajetos determinados, em vez das centenas de trajetos diferentes que ela realmente pode seguir. Seria como se a sala tivesse trajetos invisíveis orientando a bola. Assim, a lei de Bohr afirma que os elétrons agem como se o espaço ao redor do núcleo atômico possuísse trajetos invisíveis. Mas Bohr não deu justificativa para esta estranha situação.
Neste ponto chegamos à Segunda lei de Bohr
Segunda Lei: um átomo irradia energia quando um elétron salta de uma órbita de maior energia para uma de menor energia.
Além disso, um átomo absorve energia quando um elétron é deslocado de uma órbita de menor energia para uma órbita de maior energia.
Em outras palavras, os elétrons saltam de uma órbita permitida para outra à medida que os átomos irradiam ou absorve energia. As órbitas externas do átomo possuem mais energia do que as órbitas internas. Por conseguinte, se um elétron salta da órbita 2 para a órbita 1, há emissão de luz, por outro lado, se luz de energia adequada atingir o átomo, esta é capaz de impelir um elétron da órbita 1 para a órbita 2. Neste processo, a luz é absorvida.


A linha vermelha no espectro atômico é causada por elétrons saltando da terceira órbita para a segunda órbita.


A linha verde-azulada no espectro atômico é causada por elétrons saltando
da quarta órbita para a segunda órbita.


linha azul no espectro atômico é causada por elétrons saltando
da quinta órbita para a segunda órbita.


A linha violeta mais brilhante no espectro atômico é causada por elétrons saltando
da sexta órbita para a segunda órbita.
É interessante notar que os comprimentos de onda da luz encontrada no espectro do hidrogênio corresponde à diferentes órbitas. (O comprimento de onda guarda relação com a energia. Os menores comprimentos de onda de luz significam vibrações mais rápidas e maior energia). Por exemplo, a linha verde-azulada no espectro linear do hidrogênio é causada por elétrons que saltam da Quarta órbita para a Segunda órbita. A figura mostra como cada linha no espectro resulta de um determinado salto de elétrons.
Observe que todos os saltos na figura são de órbitas de maior nível para a órbita 2. O salto de mais baixa energia é o da terceira órbita para a segunda, e este salto produz a linha vermelha a 6,563 Ângstron. Finalmente, existe uma série de linhas na extremidade violeta do espectro, produzida por elétrons que saltam de órbitas externas distantes para a Segunda órbita.
No caso dos átomos de hidrogênio, somente os saltos para a Segunda órbita produzem linhas espectrais na parte visível do espectro. Os saltos para a primeira órbita produzem irradiação ultravioleta ondas mais curtas do que as luminosas, ao passo que os saltos para a Terceira, Quarta e Quinta órbita produzem irradiação infravermelha (ondas mais longas do que as luminosas).
As órbitas determinadas por Bohr e a forma pela qual os elétrons saltam entre estas destruíram a antiga imagem dos elétrons girando em espiral em direção do núcleo. Também anulara a existência de radiação atômica ser um espectro luminoso contínuo, e responsável pelo espectro linear.
Era tudo muito estranho. As idéias arrojadas e imaginativas de Bohr engendraram algo que funcionava muito bem. Mas nem Bohr nem ninguém poderia compreender exatamente como funcionava.


0 comentários:
Postar um comentário